jossain määrin kuoleman ja sairaalahoidon riskiä sydämen vajaatoiminnan vuoksi.Potilailla on kuitenkin suuri toistuvien sydämen vajaatoiminnan pahenemistapahtumien riski, kuolleisuus on edelleen noin 25 % ja ennuste edelleen huono.Tästä syystä HFrEF:n hoitoon tarvitaan edelleen kiireesti uusia terapeuttisia aineita, ja Vericiguat, uusi liukoinen guanylaattisyklaasi (sGC) -stimulaattori, tutkittiin VICTORIA-tutkimuksessa sen arvioimiseksi, voisiko Vericiguat parantaa HFrEF-potilaiden ennustetta.Tutkimus on monikeskus, satunnaistettu, rinnakkaisryhmien, lumekontrolloitu, kaksoissokkoutettu, tapahtumalähtöinen, vaiheen III kliiniset tulokset.Tutkimukseen osallistui Kanadassa sijaitsevan VIGOR-keskuksen alaisuudessa yhteistyössä Duke Clinical Research Instituten kanssa 616 tutkimuskeskusta 42 maassa ja alueella, mukaan lukien Euroopassa, Japanissa, Kiinassa ja Yhdysvalloissa.Kardiologian osastollamme oli kunnia olla mukana.Yhteensä 5 050 potilasta, joilla oli krooninen sydämen vajaatoiminta, iältään ≥ 18 vuotta, NYHA luokka II-IV, EF < 45 %, joilla oli kohonnut natriureettisen peptidin (NT-proBNP) taso 30 päivän kuluessa ennen satunnaistamista ja jotka olivat olleet sairaalahoidossa sydämen vajaatoiminnan vuoksi 6 kuukauden sisällä ennen satunnaistamista tai sai diureetteja laskimonsisäisesti sydämen vajaatoimintaan 3 kuukauden aikana ennen satunnaistamista, ja kaikki saivat ESC:tä, AHA/ACC:tä ja kansallisia/aluekohtaisia suositeltuja hoitostandardeja.Potilaat satunnaistettiin suhteessa 1:1 kahteen ryhmään, ja heille annettiin Vericiguatia (n=2526) ja lumelääkettä (n=2524) normaalihoidon lisäksi.
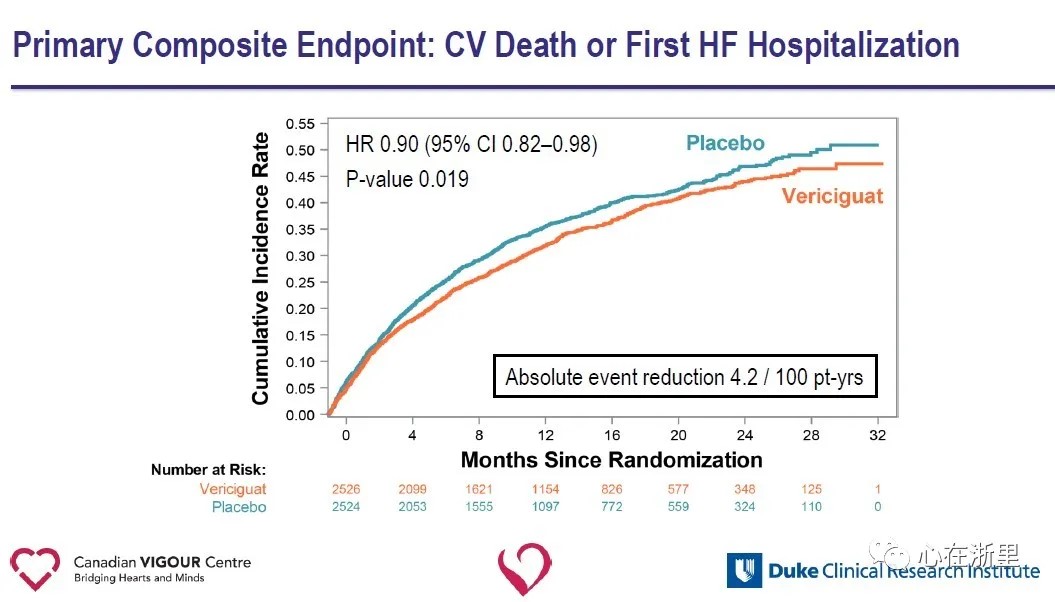
Tutkimuksen ensisijainen päätetapahtuma oli sydän- ja verisuoniperäinen kuolema tai ensimmäinen sydämen vajaatoimintaan joutuminen sairaalahoitoon;toissijaisiin päätetapahtumiin sisältyivät ensisijaisen päätetapahtuman komponentit, ensimmäinen ja myöhemmät sydämen vajaatoimintaan liittyvät sairaalahoidot (ensimmäiset ja toistuvat tapahtumat), yhdistetty päätetapahtuma, joka muodostui kaikesta kuolemasta tai sydämen vajaatoiminnasta johtuvasta sairaalahoidosta ja kaikesta kuolemasta.Keskimääräisellä 10,8 kuukauden seurannalla ensisijainen päätetapahtuma, kardiovaskulaarinen kuolema tai ensimmäinen sydämen vajaatoimintaan joutuminen, oli suhteellisesti 10 % pienempi Vericiguat-ryhmässä lumelääkeryhmään verrattuna.
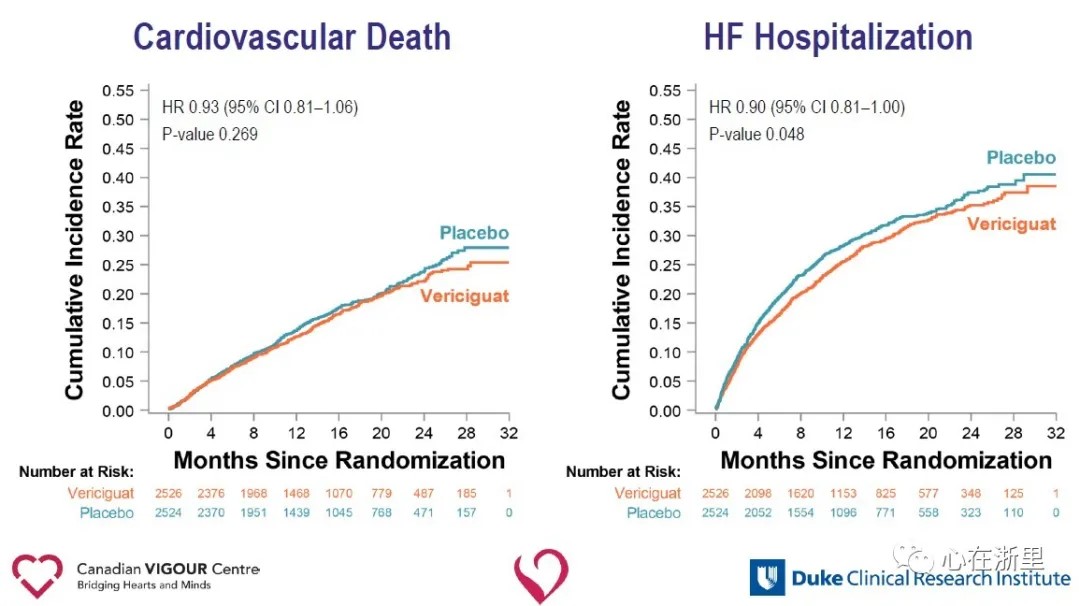
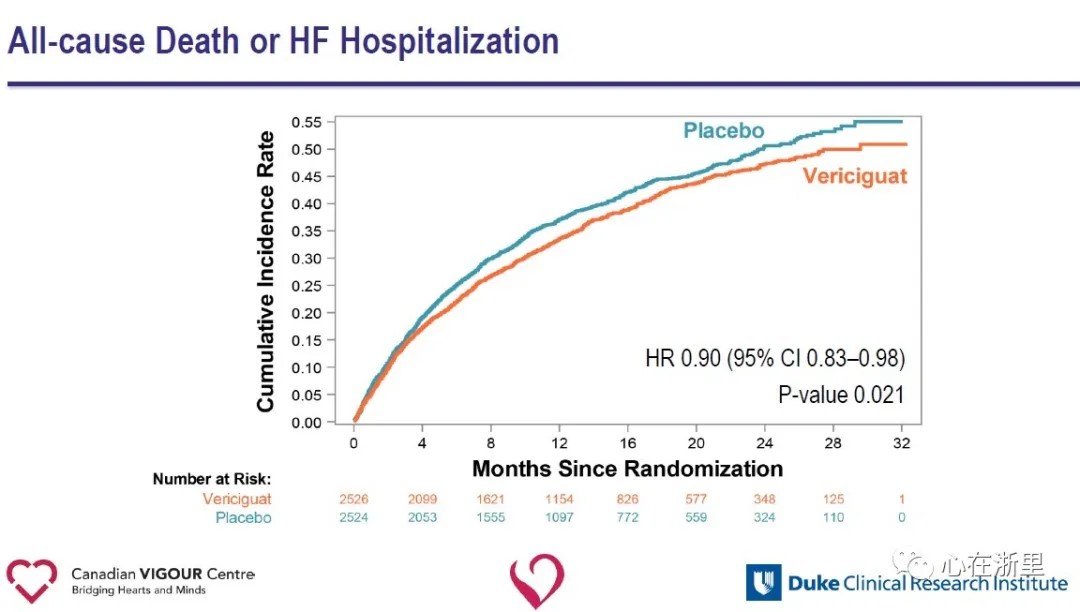
Toissijaisten päätetapahtumien analyysi osoitti, että Vericiguat-ryhmässä sydämen vajaatoimintaan joutumisen määrä väheni merkittävästi (HR 0,90) ja yhdistelmäpäätetapahtuma, joka muodostui kaikesta kuolemasta tai sydämen vajaatoimintaan joutumisesta (HR 0,90) Vericiguat-ryhmässä plaseboryhmään verrattuna.
Tutkimuksen tulokset viittaavat siihen, että Vericiguatin lisääminen sydämen vajaatoiminnan tavanomaiseen hoitoon vähentää merkittävästi viimeaikaisten pahenevien sydämen vajaatoimintatapahtumien esiintymistä ja vähentää sydän- ja verisuoniperäisen kuoleman tai sydämen vajaatoiminnan vuoksi sairaalahoidon riskiä potilailla, joilla on HFrEF.Vericiguatin kyky vähentää sydän- ja verisuonitautien kuoleman tai sydämen vajaatoiminnan sairaalahoidon riskiä potilailla, joilla on korkean riskin sydämen vajaatoiminta, tarjoaa uuden terapeuttisen tien sydämen vajaatoimintaan ja avaa uusia väyliä sydän- ja verisuonitautien tulevalle tutkimiselle.Vericiguat ei ole tällä hetkellä hyväksytty markkinointiin.Lääkkeen turvallisuutta, tehokkuutta ja kustannustehokkuutta on vielä testattava markkinoilla.
Postitusaika: 08.02.2022